本文作者:sysoon
3 年前,全球首个延缓阿兹海默症(AD)进展的新药 ADUHELM® 获批上市。
2 天前,它却退出了 AD 新药竞争的舞台。
1 月 31 日,渤健宣布:停止静脉注射用 ADUHELM®(aducanumab-avwa)100mg/mL 注射液的开发和上市,并将终止 ENVISION 临床研究。[1]

图源:Biogen
在宣布停止继续开发 Aducanumab 的同时,渤健还表示,这跟任何安全性或有效性问题都无关。
上市 970 天,争议不断
2021 年 6 月 7 日,FDA 加速审批 Aducanumab 上市,用于改善阿尔茨海默病的发生、延缓疾病进展。该药需要每月静脉输液一次,售价每年 56,000 美元(约合人民币 35.8 万元)。
Aducanumab 就此成为全球首款可以延缓 AD 进展的药物,此前获批的相关药物仅可缓解患者痴呆的症状。[2]
图源:FDA
但这个开创性药物一经获批,争议就随之而来:两项 3 期临床试验结果互相矛盾,临床获益并不明确。
渤健向 FDA 提交的临床试验资料中,主要包括 2 项 3 期临床试验。这两项试验设计思路相同,均在 2015 年启动[3]。但直到渤健提交申请都未完全完成,仅对部分试验数据进行了分析。

两项临床试验开展的时间线,图源:参考资料 3
报告中,这两项试验的多项结果都互相矛盾。同样是在高剂量 Aducanumab 患者组,一项研究中患者的临床痴呆评分(CDR-SB 量表)得到改善,但在另一项研究中,却并无统计学差异,而且从数据上看,CDR-SB 评分反而更差。[3]
其它结果也并不乐观,多个评价认知能力的量表都存在类似的矛盾结果:一组有统计学差异,另一组没有,甚至两组还存在变化趋势不同的情况。[3]
除此之外,Aducanumab 也被质疑临床获益不明确。
根据批准信息,Aducanumab 可以通过降低 AD 患者大脑中的 Aβ 水平,改善患者的认知功能。但在 FDA 的统计审查中,并没有证据表明 Aβ 水平变化与认知功能相关[4]。也就是说,Aducanumab 确实能降低 Aβ 水平,但「改善认知功能」却不一定。
FDA 加速批准半年后,一份不良反应报告将这场舆论加深:一名 75岁的女性患者在接受 Aducanumab 治疗后死亡、超过 4 成的高剂量治疗者出现脑水肿......[5]
另一个篮子里的鸡蛋:20 年来首款 FDA 完全获批
疗效存疑的药物却获批了,有人认为 FDA 在放水,有临床医生则直接表示:「就算 FDA 批准,我也不会给自己的患者开这种药。」[6]
FDA 坚持批准 Aducanumab,全球多地并未因此向其敞开大门。
2021 年 12 月,欧洲药品管理局拒绝 Aducanumab 用于治疗阿尔茨海默病的上市授权,质疑该药物的实际疗效,并要求渤健重新审查。多番权衡后,2022年 4 月 ,渤健撤回 Aducanumab 在欧洲的上市申请。[7]
同样在 2022 年 4 月,美国医疗保险和医疗补助服务中心(CMS)公示评审结果:Aducanumab 的医保覆盖,将仅限于医学中心或医院门诊开展的临床试验。[8]

图源:参考资料 8
尽管 Aducanumab 争议不断,渤健并未停止在 AD 药物领域的研究。
在宣布停止继续开发和上市 Aducanumab 的同时,渤健也表示将重点放在 lecanemab——该药物为 20 年来首款被 FDA 完全批准的 AD 治疗药物,并被列入 Science 2023 年度十大科学突破。[1,9](点击查看往期文章:20 年来首款!这款新药获 FDA 完全批准)
根据 lecanemab的 Ⅲ 期临床研究数据,Lecanemab 组在治疗 18 个月后,主要疗效终点(临床痴呆量表评分)相对基线平均下降 1.21 分,安慰剂组相对基线平均下降 1.66 分(评分降低越少表示病情进展越慢)。Lecanemab 与安慰剂两组相差 0.45 分,具有统计学和临床意义,相当于延缓疾病进展 27%。[10]
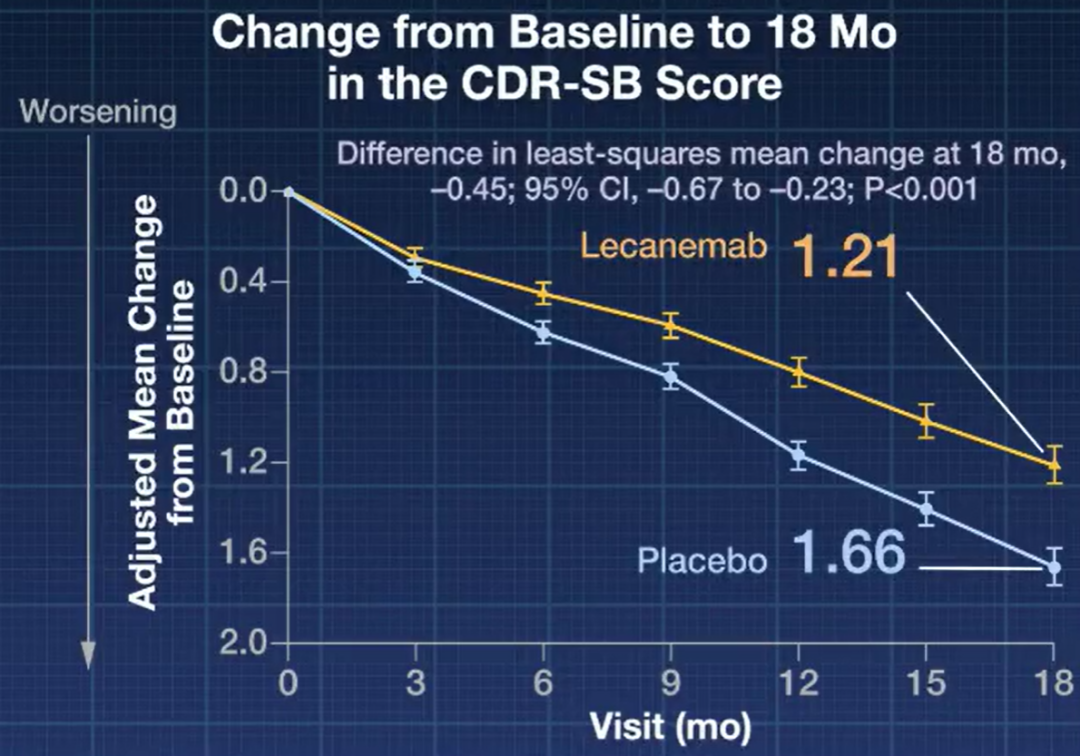
图源:参考资料 10
近日,Lecanemab 还获得国家药品监督管理局批准,主要用于治疗由阿尔茨海默病引起的轻度认知障碍和阿尔茨海默病轻度痴呆,该药将于 2024 年 7 月中旬在国内上市,上市后预计定价 2508 元。[11,12]
致谢:本文经 天津大学泰达医院神经内科主任医师 赵伟、山东大学齐鲁医院神经内科 副主任医师 温冰 专业审核
策划:sysoon|监制:gyouza、carollero
题图来源:渤健
未经允许不得转载:澳鸟-全球资讯平台 » 凉凉!一年 35 万,作为全球首款上市两年后,这几天彻底退市了

 澳鸟-全球资讯平台
澳鸟-全球资讯平台







