今日,NMPA 官网显示,神州细胞菲诺利单抗和贝伐珠单抗(SCT510)的联合疗法申请获批上市。根据神州细胞公开资料,本次获批适应症为:用于既往未接受过系统治疗的不可切除或转移性肝细胞癌患者。

图源:NMPA 官网
菲诺利单抗(SCT-I10A)是神州细胞自主研发的重组人源化抗 PD-1 IgG4 型单克隆抗体,此前已在国内获批联合化疗用于治疗头颈部鳞状细胞癌,是首个获批治疗头颈部鳞癌的国产 PD-1 单抗。
安贝珠(SCT510)是神州细胞开发的重组人源化抗 VEGF 单克隆抗体注射液,是贝伐珠单抗注射液(安维汀)的生物类似药。此前,安贝珠已获得 NMPA 批准用于治疗多种适应症,包括转移性结直肠癌、晚期/转移性或复发性非小细胞肺癌、复发性胶质母细胞瘤、肝细胞癌、宫颈癌,以及上皮性卵巢癌、输卵管癌或原发性腹膜癌。
2024 年 ASCO 年会上,神州细胞公布了在中国开展的一项开放标签、多中心、3 期试验(NCT04560894) 的中期分析数据。该研究评估了菲诺利单抗+贝伐珠单抗作为晚期肝细胞癌一线治疗的安全性和有效性,并与索拉非尼进行了比较。试验的两个共同主要终点是总生存期 (OS) 和无进展生存期 (PFS)。
截至数据截止时间(2023 年 11 月 2 日),共有 346 名患者入组并接受至少一剂治疗,其中菲诺利单抗+贝伐珠单抗组入组 230 例患者,索拉非尼组入组 116 患者,中位随访时间为 19.7 个月。试验数据显示:
1. 菲诺利单抗+贝伐珠单抗组的中位 OS 为 22.1 个月,显著长于索拉非尼组的 14.2 个月(风险比 [HR] 0.60;95% 可信区间 [CI]:0.44,0.81;p=0.0008)。
2. 菲诺利单抗+贝伐珠单抗组的中位 PFS 为 7.1 个月,也显著长于索拉非尼组的 2.9 个月(HR 0.50;95%CI:0.38,0.65;p<0.0001)。
3. 菲诺利单抗+贝伐珠单抗组的客观缓解率(ORR)为 32.8%(75/229),而索拉非尼组的 ORR 只有 4.3%(5/116)。
安全性方面,菲诺利单抗+贝伐珠单抗组 42.6% 的患者观察到 ≥3 级治疗相关不良事件 (TRAE),索拉非尼组这一数值为 33.6% 。最常见的 ≥3 级 TRAE 是高血压。

图源:Insight 数据库
肝癌是常见的恶性肿瘤之一,肝细胞癌约占原发性肝癌的 75%-85%。大多数肝细胞癌患者在诊断时已是中晚期,预后差,五年生存率比较低,临床上存在着极大的未满足医疗需求。
在很长时间内,索拉非尼一直是晚期肝细胞癌的标准治疗方案。近年来,随着免疫疗法在肿瘤领域的突破进展,晚期肝细胞癌患者也迎来了很多新的治疗方案。
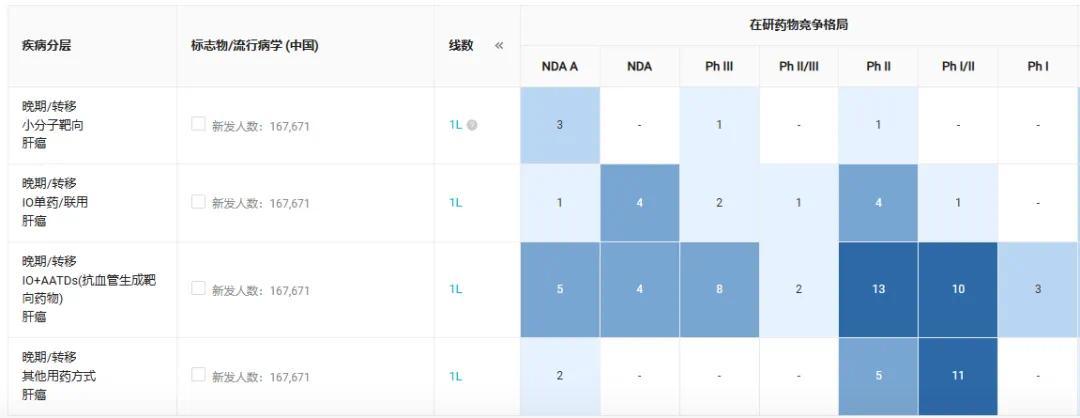
国内「晚期肝细胞癌一线治疗」在研药物竞争格局热力图,图源:Insight 数据库
Insight 数据库显示,在晚期肝细胞癌一线赛道,目前国内已有 4 款「IO+贝伐珠单抗」方案处于获批或申报上市阶段。
除了神州细胞的菲诺利单抗+贝伐珠单抗,罗氏的阿替利珠单抗+贝伐珠单抗、信达的信迪利单抗+贝伐珠单抗(IBI305)此前也已获批。此外,君实的特瑞普利单抗+贝伐珠单抗也已申报上市。
监制:云也
信息来源:国家药监局、神州细胞
丁香园 Insight 数据库作为真实可溯源的全球医药数据情报分析平台,专注于医药行业 19 年,追踪国内外 30000+ 信源,整合药品从临床前到上市后的全生命周期情报数据,为药企、投资公司、CRO 等国内外 3000+ 家企业提供数据情报服务,助力企业决策更精准,工作更高效。
特别声明:以上文章内容仅代表作者本人观点,不代表本网站观点或立场。如有关于作品内容、版权或其它问题请与我们联系删除或修改。

 澳鸟-全球资讯平台
澳鸟-全球资讯平台









